消毒薬の選び方
各種消毒薬の特徴
9.塩化ベンザルコニウム 塩化ベンゼトニウム
特徴
塩化ベンザルコニウム(ザルコニン®など)は無臭・無色で使い勝手が良く、メチシリン耐性黄色ブドウ球菌(MRSA)などの一般細菌や、カンジダなどの酵母様真菌に有効である(図21)1~5)。
また、陽イオン界面活性剤である本薬は、抗菌効果のみならず洗浄効果も期待できる。
なお、塩化ベンザルコニウムと塩化ベンゼトニウム(ベゼトン®など)は類似物質であり、これらの2薬剤を総称して第四級アンモニウム化合物という。
図21. 微生物の消毒薬抵抗性の強さと、塩化ベンザルコニウムの抗菌スペクトル
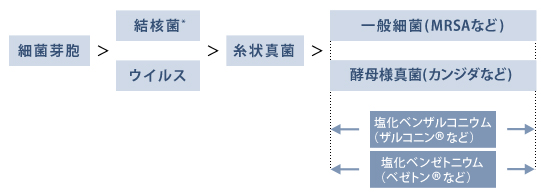
消毒対象
(1)粘膜
本薬に対する粘膜の耐容性は比較的良いため、0.02~0.05%液が腟・外陰部に、0.01~0.025%液が手術野(粘膜)や熱傷部位に用いられる。
一方、塩化ベンゼトニウムでは、0.025%液が腟・外陰部、0.01~0.025%液が手術野(粘膜)や熱傷部位に用いられるほかに、0.004%液が口腔(うがい)、0.01~0.02%液が口腔の創傷部位に適用がある。
(2)手指
0.2%塩化ベンザルコニウムと保湿剤とを含有の消毒用エタノール液が、速乾性手指消毒薬として汎用されている。目にみえる汚れが付着していない手指の消毒に適している。
(3)自己導尿用カテーテル
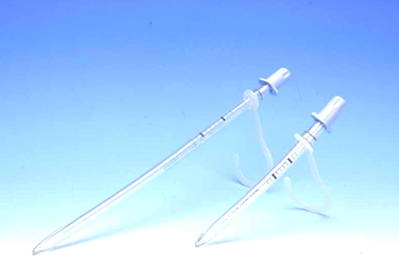
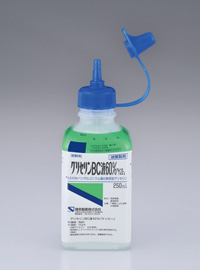
間欠的自己導尿用カテーテルの潤滑・保存液として、0.025%塩化ベンザルコニウム含有のグリセリン液(グリセリンBC液60%「ケンエー」)が汎用されている(図22)。
本液の自己導尿用カテーテルキット内への入れ替えは、微生物汚染防止の観点から、24時間または48時間ごとに行う必要がある6)。
図22. 自己導尿用カテーテルキット(左)と0.025%塩化ベンザルコニウム含有のグリセリン液(右)
(4)器具やリネン類
0.1%塩化ベンザルコニウム液への浸漬が、器具やリネン類などの洗浄を兼ねた消毒に適している。
たとえば、MRSA汚染の色・柄物リネンには、次亜塩素酸ナトリウムが使用できないので、0.1%塩化ベンザルコニウム液への30分間浸漬を用いる。
(5)環境
MRSAなどの一般細菌で汚染された環境の消毒には、0.2%塩化ベンザルコニウム液での清拭が有効である。
表7には、臨床材料からMRSAが検出された患者の周辺環境のMRSA汚染について示した7)。 本表から明らかなように、MRSA検出患者の周辺環境にはMRSAがばらまかれていることが少なくなく、この場合でのオーバーテーブルやベッド柵などの表面の消毒には、0.2%液での清拭が有効である。
表7.メシチリン耐性黄色ブドウ球菌(MRSA)を検出した患者の周辺環境のMRSA汚染(計106名)
| 調査箇所 | MRSA汚染率(%) | MRSA菌量の平均±標準偏差(範囲) |
|---|---|---|
| cfu/調査箇所 | ||
| ベッドシーツ | 40.2 | 380.2±2,198.0 (0~18,000) |
| オーバーテーブル | 22.4 | 15.2±69.5 (0~480) |
| ベッド柵 | 20.9 | 12.8±56.5 (038~0) |
| ドアノブ(室内) | 2.7 | 0.2±1.3 (0~10) |
| ドアノブ(室外) | 4.1 | 0.2±0.9 (0~5) |
*ベッドシーツ、オーバーテーブルおよびベッド柵では100cm2を、またドアノブでは全面積について調べた。
取り扱い上の留意点
適用濃度を守る
性器粘膜の消毒に0.02%塩化ベンザルコニウム含浸綿を用いるべきところを、誤って1%液含浸綿などを用いたため化学熱傷(損傷)が生じた例が少なくない。
これらの原因は希釈ミスであり、適用直後の患者からの刺激感の訴えで初めて濃度誤りに気付くことが多い。この際には、ただちにシャワー浴を行う必要がある。
希釈ミス防止の観点から、生体適用する消毒薬を薬局や病棟で希釈調製することは控えたい。希釈・滅菌済み製品の購入が勧められる。
微生物汚染を防止する
塩化ベンザルコニウムなどの低水準消毒薬は、不適切な取り扱いにより微生物汚染を受ける。
したがって、どのような取り扱いで塩化ベンザルコニウムが微生物汚染を受けるかについて理解しておく必要がある。典型的な微生物汚染パターンは次の①~③である8~10)。
① 含浸綿球の分割使用
塩化ベンザルコニウム含浸綿球(ガーゼ)を24時間以上にわたって分割使用すると、細菌汚染を受けやすくなる。
その実例を図23に示した。また表8に、自己導尿時に患者が7日間以上にわたって分割使用していた0.02%塩化ベンザルコニウム含浸綿についての調査結果を示したが、 30サンプル中20サンプル(67%)が高濃度の細菌汚染を受けていた。汚染原因としては、水分を含んだ綿(ガーゼ)が緑膿菌などにとっての好適な増殖環境となることがあげられる11)。
したがって、塩化ベンザルコニウム含浸綿球(ガーゼ)の作り換えは、乾燥または滅菌済みの容器を用いて24時間ごとに行う必要がある。
できれば、単包装の滅菌済み塩化ベンザルコニウム含浸綿球(ザルコニン®0.025%綿球)の使用が望ましい(図24)。
図23. 0.02%塩化ベンザルコニウム含浸綿の細菌汚染
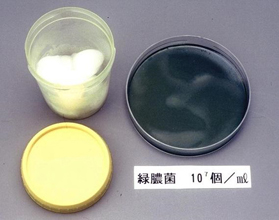
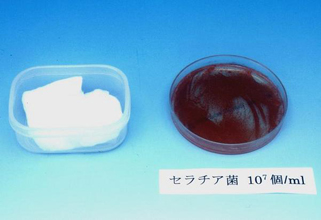
- 左:緑膿菌汚染例;3か月間にわたって分割・つぎ足し使用を行っていた。
- 右:セラチア汚染例;7日間にわたって分割使用を行っていた。
図24. 単包装の滅菌済み0.025%塩化ベンザルコニウム含浸綿球

衛生的である。
表8.間欠的自己導尿に使用していた0.02%塩化ベンザルコニウム綿の細菌汚染*
| サンプル番号 | 汚染菌量 /mL |
おもな汚染菌 |
|---|---|---|
| 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 |
1.5×108 6.4×107 4.0×107 3.5×107 3.5×107 2.4×107 1.8×107 1.6×107 1.1×107 1.0×107 7.8×106 7.8×106 6.0×106 3.1×106 5.5×105 5.0×105 4.5×105 2.0×105 1.5×105 9.0×103 |
GNGB** Pseudomonas fluorescens Serratia marcescens Serratia marcescens Comamonas acidovorans 緑膿菌 Enterobacter agglomerans Aeromonas hydorophila/caviae Pseudomonas spp. Serratia marcescens Alcaligenes xylosoxidans Pseudomonas spp. Pseudomonas aureofaciens GNGB 緑膿菌 GNGB Alcaligenes xylosoxidans Pseudomonas spp. Pseudomonas fluorescens GNGB |
| 21~30 | 0 |
- *しぼり液1mLについて調べた。
- **同定できなかったブドウ糖非発酵菌
② 気管内吸引チューブ浸漬用消毒薬として使用
塩化ベンザルコニウム液を気管内吸引チューブ浸漬用として用いると、細菌汚染が生じやすくなる。 塩化ベンザルコニウム中に痰などが混入すると、Burkholderia cepacia(セパシア菌)などが増殖してくるからである。
したがって、気管内吸引チューブ浸漬用として、塩化ベンザルコニウムの単剤を用いることは避けたい。 8%エタノールを添加した0.1%塩化ベンザルコニウム液(ザルコニン®A液0.1など)を用いる。
なお、8%エタノール添加の0.1%塩化ベンザルコニウム液の使用開始後の使用期限は、吸引回数に応じて1~7日間とする。
③ 局所洗浄装置(イルリガートル)へつぎ足し使用
保温型の局所洗浄装置は内部構造が複雑なため、汚れが付きやすくかつ乾燥させにくい。
したがって、本装置へ0.02%塩化ベンザルコニウムなどを長期間にわたってつぎ足し使用すると、Burkholderia cepaciaなどの汚染を受ける。 汚染防止法としては、14日間ごとなどの装置内のアルコールフラッシュとその後の乾燥があげられる。
表9に、塩化ベンザルコニウム液の微生物汚染パターンとその防止法をまとめた。
表9. 塩化ベンザルコニウムの微生物汚染パターンとその防止法
| 使用法 | 汚染パターン | 防止法 |
|---|---|---|
 綿球やガーゼに浸して使用 |
24時間を超える分割使用やつぎ足し使用 |
|
 気管内吸引チューブの浸漬に使用 |
くり返し使用 |
|
 局所洗浄装置 (イルリガートル)で使用 |
1か月間などの長期にわたるつぎ足し使用 |
|
誤飲を防ぐ
塩化ベンザルコニウムの経口毒性は高く、10%製品の成人致死量は10~30mLである。
実際、本薬の誤飲による死亡事例が少なくない12)。したがって、本薬を患者の手の届く場所に置いたり、ペットボトルなどの他の容器に移し換えて用いることは避けるべきである。
図25.患者の手が届く場所に放置された塩化ベンザルコニウム液


左:10%製品を洗面台に放置した例、右:10%製品をペットボトルに移し換えて流し台に放置した例
引用文献
- Roger LA, Janice HC, Walter WB, et al: Susceptibility of vancomycin-resistant enterococci to environmental disinfectans. Infect. Control Hosp. Epidemiol. 1997; 18, 195-199.
- William AR, Susan LB, Newman CA, et al: Antimicrobial activity of home disinfectants and natural products against potential human pathogens. Infect. Control Hosp. Epidemiol. 2000; 21, 33-38.
- Takeo Y, Oie S, Kamiya A, et al: Efficacy of disinfectants against biofilm cells of Pseudomonas aeruginosa. Microbios 1994; 79, 19-26.
- Oie S, Huang Y, Kamiya A,, et al: Efficacy of disinfectants against biofilm cells of methicillin-resistant Staphyloclccus aureus. Microbios 1996; 85, 223-230.
- Silverman J, Vazquez JA, Sobel JD, Jack DS, et al: Conmparative in vitro activity of antiseptics and disinfectants versus clinical isolates of Candida species. Infect. Control Hosp. Epidemiol. 1999; 20, 676-684,.
- Oie S, Kamiya A, Seto T, et al: Microbial contamination of in-use lubricants for non-touch urethral catheters in intermittent self-catheterization. Biol. Pharm. Bull. 2000; 23, 781-783.
- Oie S, Suenaga S, Sawa A, et al: Association between isolation sites of methicillin-resistant Staphylococcus aureus (MRSA) in patients with MRSA-positeve body sites and MRSA contamination in their surrounding environmental surfaces. Jpn. J. Infect Dis. 2007; 60, 367-369.
- Oie S, Kamiya A: Microbial contamination of antiseptic-soaked cotton balls. Bio.l Pharm. Bull. 1997; 20, 667-669.
- Oie S, Kamiya A: Microbial contamination of antiseptic and disinfectants. Am. J. Infect. Control 1996; 24, 389-395.
- 尾家重治, 神谷 晃: 気管内吸引チューブの微生物汚染とその対策. 日環感. 1993; 8, 15-18.
- Oie S,Yoshida H, Kamiya A: Microbial contamination of water-soaked cotton gauze and its cause. Microbios 2001; 104, 159-166.
- Chataigner D, Garnier R, Sans S, et al: Intoxication aigue accidentelle par un disinfectant hospitalier. Presse. Med. 1991; 20, 741-743.







